
**产品监管文件
《**产品卫生安 全评价规定》(卫监督发〔2009〕105号),为加强取消许可的**产品的事后监督管理,建立卫生安 全评价制度。
《**产品卫生安 全评价规定》(国卫监督发〔2014〕36号)和《**产品卫生监督工作规范》(国卫监督发〔2014〕40号)按照**产品用途、使用对象实行风险监管,将**产品分为三类监管。产品责任单位应当在**类、第二类**产品**上市前自行或者委托第三方进行卫生安 全评价,形成《**产品卫生安 全评价报告》。卫生安 全评价合格的**产品方可上市销售。
《**产品卫生安 全评价技术要求》(WS 628-2018)作为**产品卫生安 全评价技术要求**制定的强制性卫生标准,与《**产品卫生安 全评价规定》(国卫监督发〔2014〕36号)配套使用。
**产品分类
按照**产品用途、使用对象的风险程度将**产品分为三类:
1、是具有较高风险,需要严格管理以保 证安 全、有效的**产品,包括用于医疗器械的高水平**剂和**器械、灭 菌剂和灭 菌器械,皮肤、黏膜**剂,生物指示物、灭 菌效果化学指示物。
2、是具有中度风险,需要加强管理以保 证安 全、有效的**产品,包括除**类产品外的**剂、**器械、化学指示物,以及带有灭 菌标识的灭 菌物品包装物、抗(抑)菌制剂。
3、是风险程度较低,实行常规管理可以保 证安 全、有效的除抗(抑)菌制剂外的卫生用品。(注:不需要备案)
其中食具消毒柜属于第二类消毒产品。
同一个**产品涉及不同类别时,应当以较高风险类别进行管理。
消毒产品卫生安 全评价
适用范围
消毒产品卫生安 全评价适用于在**境内生产、经营的不需要行政审批的消毒类、第二类消毒产品。
具体检验项目及要求
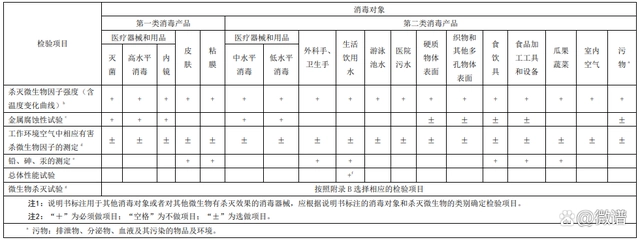
根据《**产品卫生安 全评价技术要求》(WS 628-2018)要求,具体检验项目如下:
**器械检验项目
卫生安 全评价报告模板
详见《**产品卫生安 全评价技术要求》(WS 628-2018)附 录 A(规范性附录)**产品卫生安 全评价报告格式。
备案类型与要求
**备案
产品责任单位应当在**类、第二类**产品**上市前自行或者委托第三方进行卫生安 全评价,形成《**产品卫生安 全评价报告》,对评价结果负责。卫生安 全评价报告资料齐全并符合要求。
备案材料包括基本情况和评价资料:
基本情况,包括封面、基本情况表、评价资料目录和备案登记表;
市售标签(铭牌)、市售说明书;
检验报告(含结论);
国产产品备案企业标准或进口产品质量标准;
国产产品生产企业卫生许可证或进口产品生产国(地区)允许生产销售的证明文件及报关单;
**剂、抗(抑)菌制剂产品**;
**器械结构图(主要元器件及参数);
其他(产品照片、委托加工合同、商标文件等)。
更新备案
上市后的**产品有以下情形改变的,产品责任单位应对相关检验项目重新检测并更新评价资料:
a)实际生产地址迁移、另设分厂或车间、转委托生产加工的;
b)**剂、抗(抑)菌制剂、生物指示物、化学指示物、带有灭 菌标识的灭 菌物品包装物及PCD延长产品有效期的;
c)**剂、**器械和抗(抑)菌制剂增加使用范围或改变使**产品卫生安 全评价报告更新情况真实,变更内容资料齐全并符合要求。
备案材料包括:
基本情况,包括更新备案情况说明、封面、基本情况表、评价资料目录和备案登记表;
市售标签(铭牌)、市售说明书;
检验报告(含结论);
国产产品备案企业标准或进口产品质量标准;
国产产品生产企业卫生许可证或进口产品生产国(地区)允许生产销售的证明文件及报关单;
**剂、抗(抑)菌制剂产品**;
**器械结构图(主要元器件及参数);
其他(产品照片、委托加工合同、商标文件等)。
重新备案
**产品卫生安 全评价报告重新备案须产品属于**类**产品,对产品关键项目进行重新检验。两年内国 家监督抽查合格的检验项目可不再做。
备案材料包括:
基本情况,包括重新备案情况说明、封面、基本情况表、评价资料目录和备案登记表;
市售标签(铭牌)、市售说明书;
检验报告(含结论);
国产产品备案企业标准或进口产品质量标准;
国产产品生产企业卫生许可证或进口产品生产国(地区)允许生产销售的证明文件及报关单;
**剂、抗(抑)菌制剂产品**;
**器械结构图(主要元器件及参数);
其他(产品照片、委托加工合同、商标文件等)。
备案服务平台
**产品责任单位在**类和第二类**产品**上市前需要进行卫生安 全评价,可将有关卫生安 全评价报告录入**信息服务平台进行备案。
**信息服务平台于2018年10月8日上线运行,主要是为****产品责任单位提供**产品卫生安 全评价网上备案服务,为社会监督和信息查询、社会信用体系建设、监督机构开展事中事后监督执法提供规范统一的信息服务。
申请方式
网上申请:责任单位通过**一体化政务服务平台或****产品网上备案信息服务平台上传备案材料电子档。
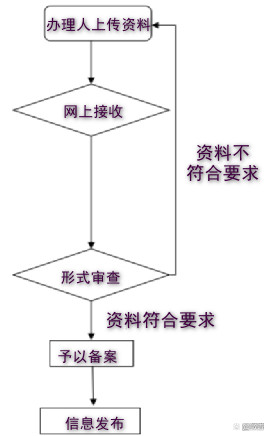
备案基本流程如下:
审查形式
省(市)卫生健康行政部门对**产品卫生安 全评价报告备案材料进行形式审查。对通过形式审查的**产品卫生安 全评价报告予以备案;对形式审查未通过的,在平台上远程反馈需补充提交或修改材料的意见。对产品责任单位上传的无须卫生安 全评价的产品相关材料直接予以退回。
**产品卫生安 全评价报告形式审查内容包括资料的完整性、规范性和合法性。
(一)完整性审查包括以下内容:
1.材料齐全,应当符合《**产品卫生安 全评价规定》、《**产品卫生安 全评价技术要求》(WS 628-2018)和本办法的规定;
2.填写内容应当完整、无漏项和缺项;
3.检验项目齐全,应当符合《**产品卫生安 全评价规定》和《**产品卫生安 全评价技术要求》(WS 628-2018)的规定。
(二)规范性审查包括以下内容:
1.材料内容应当前后一致,如产品名称、剂型/型号、责任单位和实际生产企业名称、实际生产地址等;
2.材料应当清晰,无涂改;
3.材料逐页加盖责任单位公章,**产品生产企业卫生许可证复印件还需加盖实际生产企业公章。
(三)合法性审查包括以下内容:
1.产品名称、标签(铭牌)、说明书应当符合《**产品标签说明书通用要求》(GB 38598-2020)的有关规定,不得使用已批准的药品名;
2.产品标签说明书不得出现或暗示疾病..效果;
3.国产产品的企业标准依法备案并在有效期内;
4.国产产品的**产品生产企业卫生许可证在有效期限内,且备案产品在许可核准的生产类别范围内。
备案信息发布
省(市)卫生健康行政部门将批准备案的**产品信息在****产品网上备案信息服务平台上予以公开,涉及商业秘密的信息不予公开。
信息发布内容包括产品名称、产品风险程度分类(**类或第二类)、剂型、型号、规格、使用范围、产品责任单位名称和统一社会信用代码、实际生产企业名称、**产品生产企业卫生许可证号、卫生安 全评价结论、评价日期、市售产品标签、铭牌、说明书、检验报告、备案日期等。
事中事后监管
省卫生健康行政部门负责本省**产品监管工作,充分利用网络平台,加强**类、第二类**产品卫生安 全评价报告备案情况巡查,建立省、市、县际间协查机制。
地方各级卫生健康行政部门及卫生监督执法机构开展本辖区**产品生产企业和**产品监督执法工作,将当年备案的**产品纳入年度重点抽查内容。同时,将**产品卫生安 全评价报告备案和事中事后监管结果应用于企业信用体系建设,建立政府部门间协同监管、信息共享、联合惩戒等综合监管机制。
参考资料:
《**产品标签说明书通用要求》(GB 38598-2020)
《**产品卫生安 全评价技术要求》(WS 628-2018)
《**产品卫生安 全评价规定》(国卫监督发〔2014〕36号)
《**产品卫生监督工作规范》(国卫监督发〔2014〕40号)
《**产品卫生安 全评价报告网上备案办事指南》
 当前位置:
当前位置:
